
第一作者:朱倩
论文引用:Water Research, 2023, 243, 120421
全文下载:https://doi.org/10.1016/j.watres.2023.120421
近日,华中科技大学环境学院FunMat课题组在《Water Research》上发表了题为“Revealing the roles of chemical communication in restoring the formation and electroactivity of electrogenic biofilm under electrical signaling disruption”(揭示电信号通讯阻滞下化学信号通讯在修复电活性生物膜形成及电化学活性中的作用)的研究论文(Water Research, 2023, 243, 120421)。
Qian Zhu, Dingkang Qian, Mengjiao Yuan, Zhen Li, Ziming Xu, Sha Liang, Wenbo Yu, Shushan Yuan, Jiakuan Yang, Huijie Hou*, Jingping Hu*, Revealing the roles of chemical communication in restoring the formation and electroactivity of electrogenic biofilm under electrical signaling disruption, Water Research, 2023, 243, 120421
亮点
• 证实了在电信号通讯阻滞下,胞内c-di-GMP信号通讯自发得到强化。
• 阐明了在电信号通讯阻滞下,外源 N-酰基高丝氨酸内酯 有助于修复电活性生物膜形成和电化学活性 ,但会削弱 c-di-GMP的 优势。
• 钾离子通道阻断剂和外源
N-酰基高丝氨酸内酯
均
能诱导
Geobacter
的选择性富集
。
• 电信号通讯阻滞下,Thauera在c-di-GMP信号调节中发挥了关键作用。
研究进展
生物电化学系统(MES)兼具污水处理和能源转化的优势,在环境污染治理和能源回收等方面展现出广泛的应用前景。电活性生物膜是生物电化学系统的重要功能组成,其形成过程受多种形式的信号通讯方式调控,包括胞外N-酰基高丝氨酸内酯类(N-acylhomoserine lactones,简称AHLs)介导的群体感应,胞内c-di-GMP介导的信号通讯,以及细胞内钾离子的释放及空间传播所介导的电信号通讯。然而,多种信号通讯方式间相互作用的研究仍处于起步阶段。本研究探讨了在电信号通讯阻滞(加入一种广谱钾离子通道阻断剂四乙基氯化铵,简称TEA)下,胞内c-di-GMP信号通讯与胞外AHLs介导的群体感应在混菌电活性生物膜形成过程中的相互作用。宏基因组分析表明,在电信号通讯阻滞下,胞内c-di-GMP自发得到强化,占主导作用的DGC(即编码胞内c-di-GMP生成的基因)通过介导胞外多糖的合成最终诱导了生物膜的形成。同时,通过加入外源 N-(3-氧代十二烷酰基)-L-高丝氨酸内酯(简称HSL)强化群体感应也有利于修复电活性生物膜的形成,但它减轻了电信号通讯阻滞压力,进而削弱了胞内c-di-GMP优势。有趣的是,在电信号通讯阻滞下,添加或不添加外源HSL均诱导了Geobacter的选择性富集,使得电活性生物膜中Geobacter相对丰度分别可达到85.5%和30.1%。功能贡献度分析表明,Geobacter和Thauera在胞内c-di-GMP信号通讯中发挥着重要作用,尤其是Thauera在抵抗电信号通讯阻滞胁迫方面起到至关重要的作用。本研究从信号通信角度提出了调控电活性生物膜形成和电化学活性的潜在策略(图1)。

图1 图文摘要
启动过程的输出电压图表明,20 mM TEA对电活性生物膜形成的抑制可通过加入50 μM的HSL信号分子得以恢复。如图2所示,空白对照组MFC(blank)在运行的第5天,首次达到了其最大输出电压424.3±3.2 mV。20 mM TEA的加入极大地抑制了电活性生物膜的形成,表现在早期驯化期间(20天内),MFC(TEA)几乎没有电压输出,且第一次达到最高电压388.7±6.0 mV所需要的时间最长,为28天。因此,20 mM TEA的加入不仅延长了MFCs的启动时间,而且还降低了最大输出电压。而MFC(TEA+HSL)在第5天获得了与MFC(blank)相当的最大输出电压,即436.9±15.0 mV。
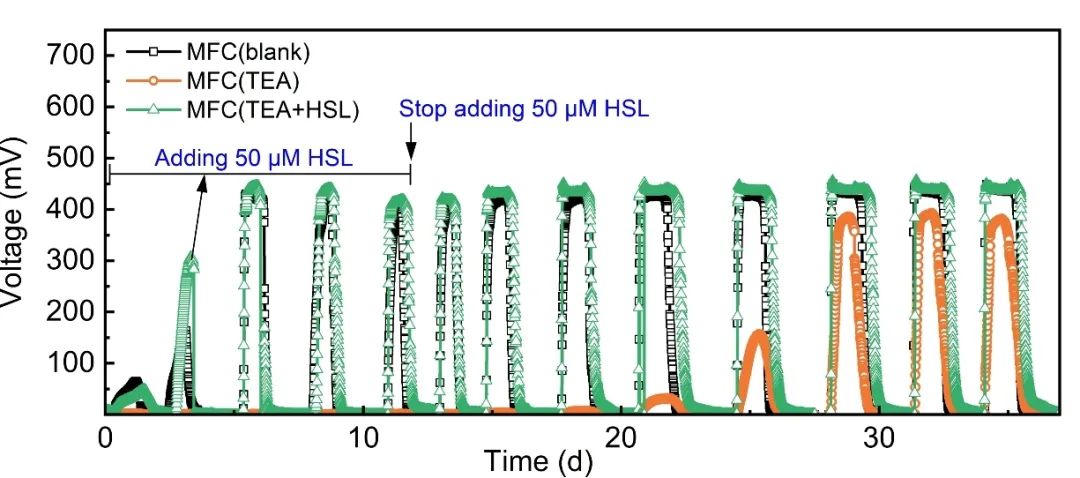
图2 各反应器的输出电压图。MFC(TEA)是指在所有运行周期中向基质中加入了浓度为20 mM的钾离子通道阻断剂TEA;MFC(TEA+HSL)是指在所有运行周期中向基质中加入TEA基础上,另在前五个周期中加入浓度为50 μM 的群体感应信号分子HSL
非周转条件的电化学分析方法表明,50 μM HSL对TEA引起的电化学活性受损具有一定的补偿效应,能够使得电化学活性恢复到与空白对照组相当的水平。如图3a所示,MFC(blank)在−0.3~−0.1 V(vs. Ag/AgCl)的电位范围内存在一个氧化峰,相应的峰电流为0.51 mA;MFC(TEA)在此电位范围内几乎没有氧化峰,而加入外源化学信号HSL后此范围的氧化峰逐渐恢复。DPV结果显示,MFC(blank)的阳极生物膜存在四个主要的氧化峰,电位分别为−0.41 V、−0.34 V、−0.25 V和−0.16 V,这些氧化峰均参与了阳极生物膜的胞外电子传递过程(图3b)。位于−0.25 V和−0.16 V处的氧化峰在MFC(TEA)中几乎消失,说明TEA的加入抑制了一些电化学活性物质的生成。而MFC(TEA+HSL)在电位为−0.35~−0.2 V范围内显示出一个宽的氧化峰,且在电位为−0.14 V时有一个明显的氧化峰。
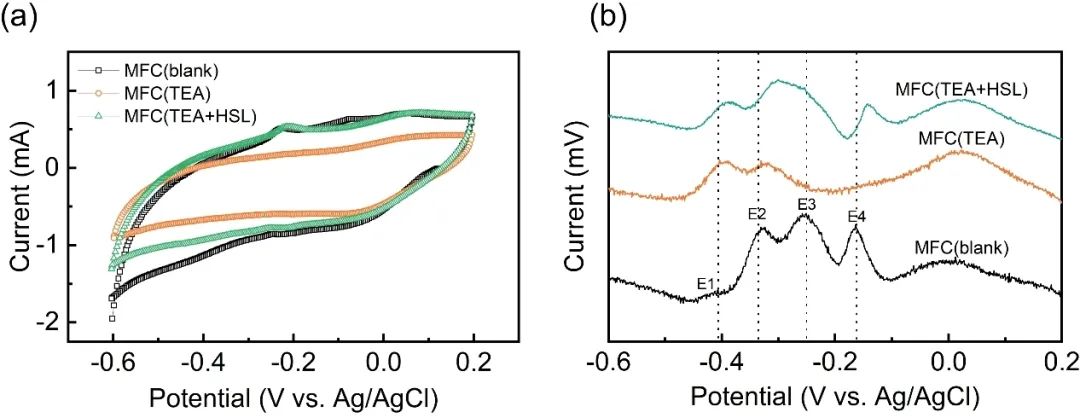
图3 (a)在培养35天后,阳极生物膜在5 mV s-1扫描速率下的非周转CV曲线;(b)非周转DPV 曲线
采用激光共聚焦显微镜(CLSM)对生物膜平均细胞活性和胞外聚合物(EPS)进行分析的结果表明,外源HSL能够提高电活性生物膜的活性和EPS中蛋白组分比例,这可能是其修复生物膜形成和电化学活性的关键因素(图4a-c)。与MFC(blank)相比,20 mM TEA的加入显著降低了电活性生物膜的活性,活细胞比例减少,死细胞比例增加,甚至出现团聚的死细胞(图4a)。当加入外源信号分子HSL后,整个生物膜活细胞的比率、紧密度也随之提高,说明外源HSL能够改善电活性生物膜的结构,可以提高生物膜的活性。与MFC(blank)相比,20 mM TEA的加入使得EPS中不导电胞外多糖的比例有所提高,蛋白的比例有所降低(图4b)。当加入外源信号分子HSL后,胞外多糖的比例有所降低,而蛋白的比例有所增加,表明外源HSL有助于提高EPS中蛋白比例。并且,相较于其它反应器中阳极生物膜的EPS,MFC(TEA+HSL)生物膜的EPS较为致密。
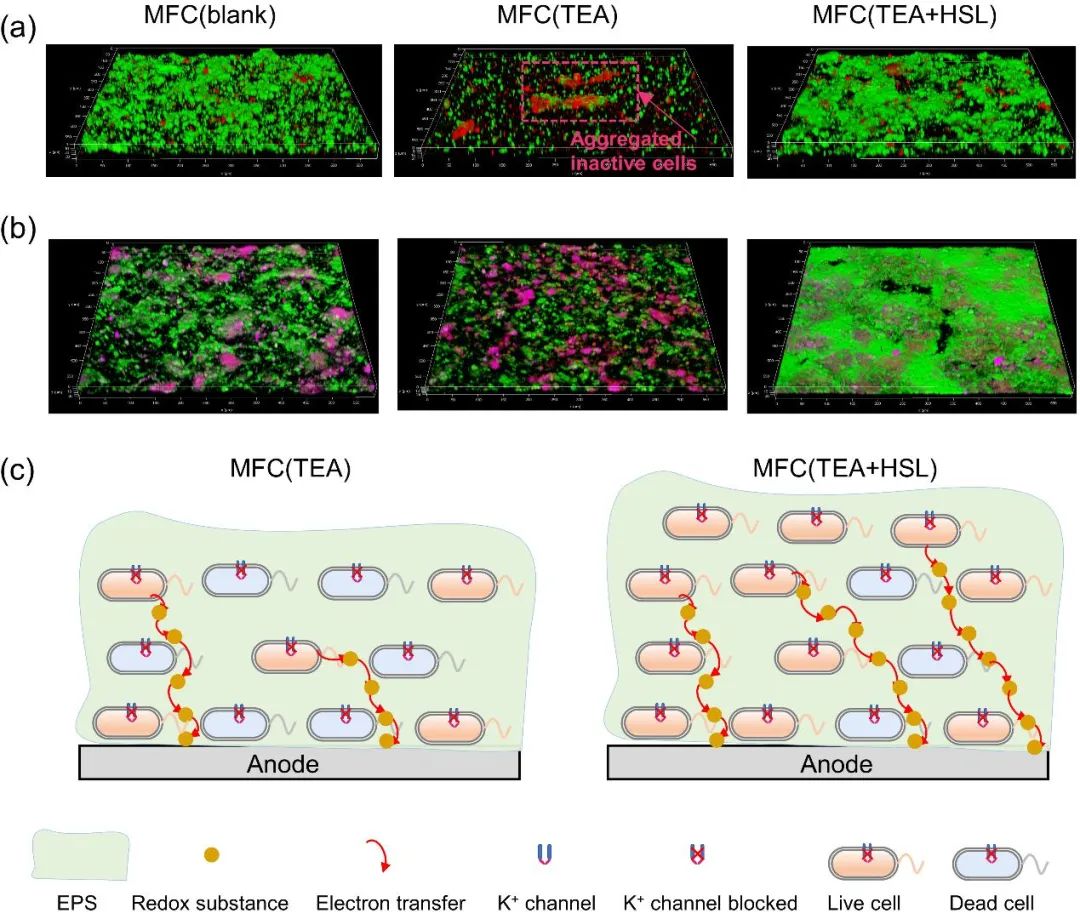
图4 (a)阳极生物膜细胞活性的CLSM图像(绿色代表活细胞,而红色代表死细胞);(b)阳极生物膜EPS组分的CLSM 图像(绿色和玫红色分别代表蛋白质和多糖);(c)TEA和HSL影响电活性生物膜特性的示意图:外源HSL提高了阳极生物膜的细胞活性和生物量,并调控了EPS组分
阳极生物膜群落结构分析表明,Geobacter和Thauera的选择性富集可能有助于缓解TEA所导致的阳极生物膜信号通讯压力。如图5a所示,在MFC(blank)阳极生物膜中,Geobacter,Chryseobacterium和Arenimonas是优势菌,相对丰度分别是18.8%,6.3%和4.0%。20 mM TEA的加入改变了阳极生物膜的群落结构,富集了Geobacter和Thauera,相对丰度分别是30.1%和33.5%。因此,TEA的加入有助于Geobacter和Thauera的选择性富集。研究表明,Geobacter具有编码产生AHLs和c-di-GMP信号分子的基因,这有助于其在电信号通讯阻滞下的选择性富集。Thauera被证明是高酚类负荷下c-di-GMP相关基因的主要贡献者之一,当进水有机负荷突然增加时,Thauera可以分泌更多的胞内c-di-GMP用于好氧污泥颗粒化。因此,MFC(TEA)阳极生物膜中最高的Thauera相对丰度,表明MFC(TEA)中的微生物群落能够分泌更多的胞内c-di-GMP信号来应对电信号通讯阻滞。同时,在MFC(TEA+HSL)阳极生物膜中,Thauera相对丰度低至0.4%,表明外源HSL可能减缓了TEA所导致的阳极生物膜信号通讯压力。采用指示琼脂平板法对各反应器主体溶液中AHLs信号分子的相对含量进行探究,结果表明MFC(TEA)和MFC(TEA+HSL)主体溶液中AHLs信号分子的浓度均比MFC(blank)高(图5b)。
宏基因组分析表明,阳极生物膜能够根据微生物所处的环境条件,而进行相应的基因调控,信号分子的类型最终是外部环境影响的结果(图5c)。基因hdtS是合成种内化学信号分子AHLs的关键基因之一;luxS是合成种间化学信号分子AI-2的关键基因;DGC相关基因主要负责合成细菌中普遍存在的第二信使c-di-GMP;rpfF是合成种内和种间信号分子DSF的关键基因。MFC(blank)阳极生物膜中主要的化学信号合成基因是luxS和rpfF,MFC(TEA)阳极生物膜中主要的化学信号合成基因是DGC和hdtS,因此,20 mM TEA的加入可能改变了阳极生物膜中的化学信号分子类型。值得注意的是,在TEA胁迫下,DGC的相对丰度增幅高于hdtS(分别为116.0%和24.9%),且在MFC(TEA)中,DGC的相对丰度显著高于hdtS(分别为6.32×10-4和4.74×10-4),表明c-di-GMP信号可能成为MFC(TEA)中最重要的信号通讯类型,是对TEA胁迫的适应性响应。与MFC(TEA)相比,MFC(TEA+HSL)中阳极生物膜DGC的相对丰度从6.32×10-4下降到4.65×10-4,表明c-di-GMP介导的信号通讯的贡献度可能下降,也进一步说明50 μM HSL的加入缓解了TEA所造成的阳极生物膜中细胞间信号通讯压力。并且,hdtS的相对丰度(4.70×10-4)略高于DGC(4.65×10-4),表明在MFC(TEA+HSL)中,最主要的信号分子基因类型可能是hdtS,其产物AHLs主要作为种内信号分子,有助于特定功能的微生物的富集,这与MFC(TEA+HSL)阳极微生物群落组成(85.5% Geobacter)具有一致性。因此,阳极生物膜信号通讯类型最终受外部环境影响。
综上所述,微生物两种化学信号通讯方式,即由AHLs介导的群体感应和c-di-GMP介导的信号通讯,能够根据微生物所处的环境条件,而进行相应的基因调控,即当阳极生物膜的电信号通讯被阻滞(即环境中仅存在TEA)时,由c-di-GMP介导的信号通讯可能成为阳极生物膜最主要的通讯方式(图5d)。同时,AHLs介导的群体感应也存在一定的增强,但其相对丰度和上升幅度均低于c-di-GMP相关基因。另一方面,当在电信号通讯方式被阻滞时加入外源HSL(即当环境中同时存在TEA和HSL)时,由c-di-GMP介导的信号通讯的贡献可能下降,AHLs介导的群体感应可能成为阳极生物膜最主要的通讯方式。
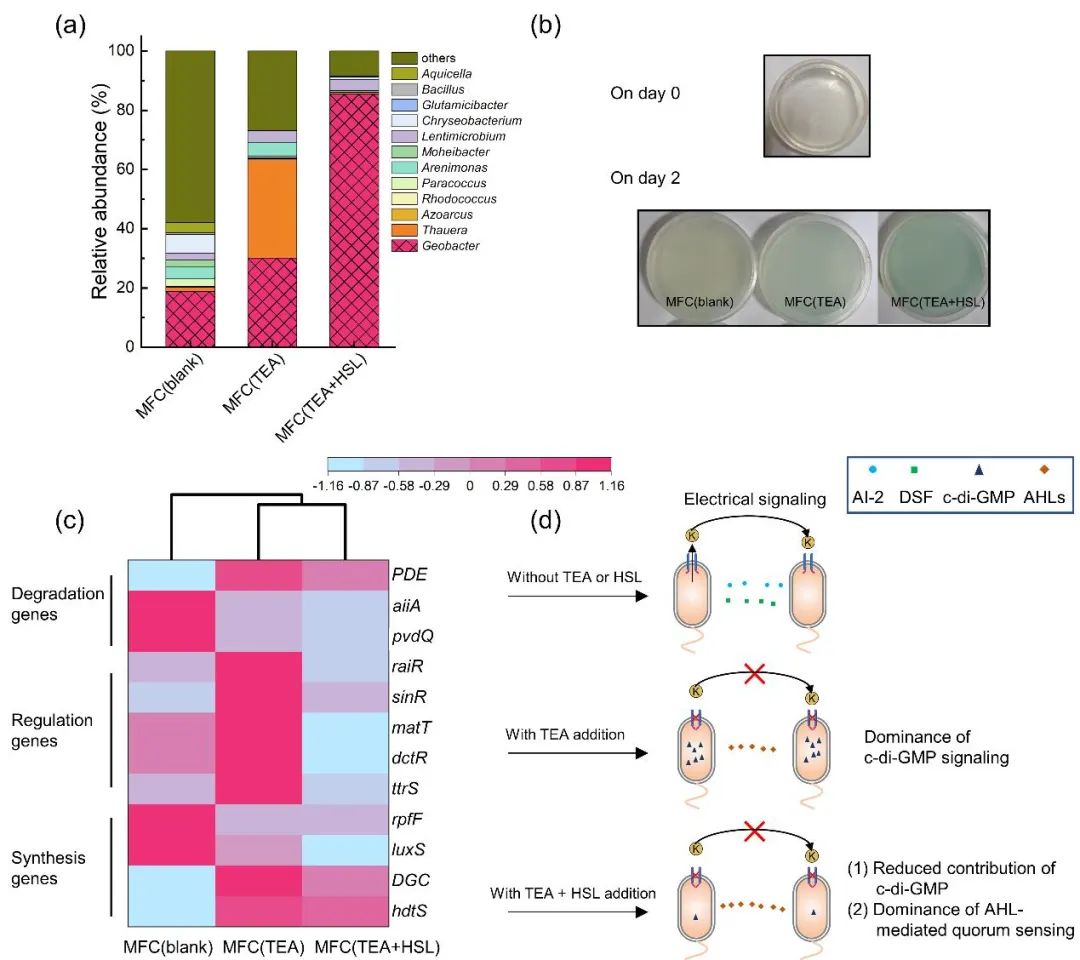
图5 (a)阳极生物膜的群落组成(基于属水平);(b)各反应器中主体溶液的相对 AHL 含量;(c)与化学信号通讯相关的合成、调控和降解基因相对丰度的比较;(d)电信号通讯阻滞强化了胞内c-di-GMP信号通讯和胞外AHLs介导的群体感应,胞内c-di-GMP信号在MFC(TEA)中占主导地位,而胞外AHLs介导的群体感应可能在 MFC(TEA+HSL)中占主导地位
功能贡献度分析表明,电信号通讯阻滞下,Thauera在c-di-GMP信号调节中发挥了关键作用。如图 6a 所示,Geobacter基因组中含有编码AHLs合成的hdtS基因,其在MFC(blank)、MFC(TEA)和MFC(TEA+HSL)中对hdtS基因贡献度分别为32.31%、38.89%和50.86%。此外,Thauera基因组中也具有hdtS基因,其在三个反应器中对hdtS基因的贡献度分别为3.90%、11.32%和0.25%,这表明Thauera的选择性富集促进了MFC(TEA)中的化学信号通讯。如图 6b所示,K21020基因的主要贡献者是Geobacter,这表明Geobacter拥有编码c-di-GMP合成的基因。在MFC(TEA)中,K13590的主要贡献者是Thauera(相对贡献率:38.15%),且Thauera在MFC(TEA)中的相对丰度较高(33.5%),表明在电信号通讯阻断下,Thauera在c-di-GMP信号通讯过程中发挥关键作用。如图6c所示,在AHLs信号降解方面,aiiA主要来源于一些相对丰度较低的菌种,如Acidipropionibacterium。如图6d 所示,在三个反应器中,K20966基因均来自Shinella菌。Aminivibrio和Pseudomonas是K21024基因的主要贡献者。值得注意的是,K13243基因来自Thauera,仅存在于MFC(blank)和MFC(TEA)中。考虑到Thauera还拥有编码c-di-GMP合成的K13590基因,因此Thauera在调控c-di-GMP信号通讯中起着重要作用。
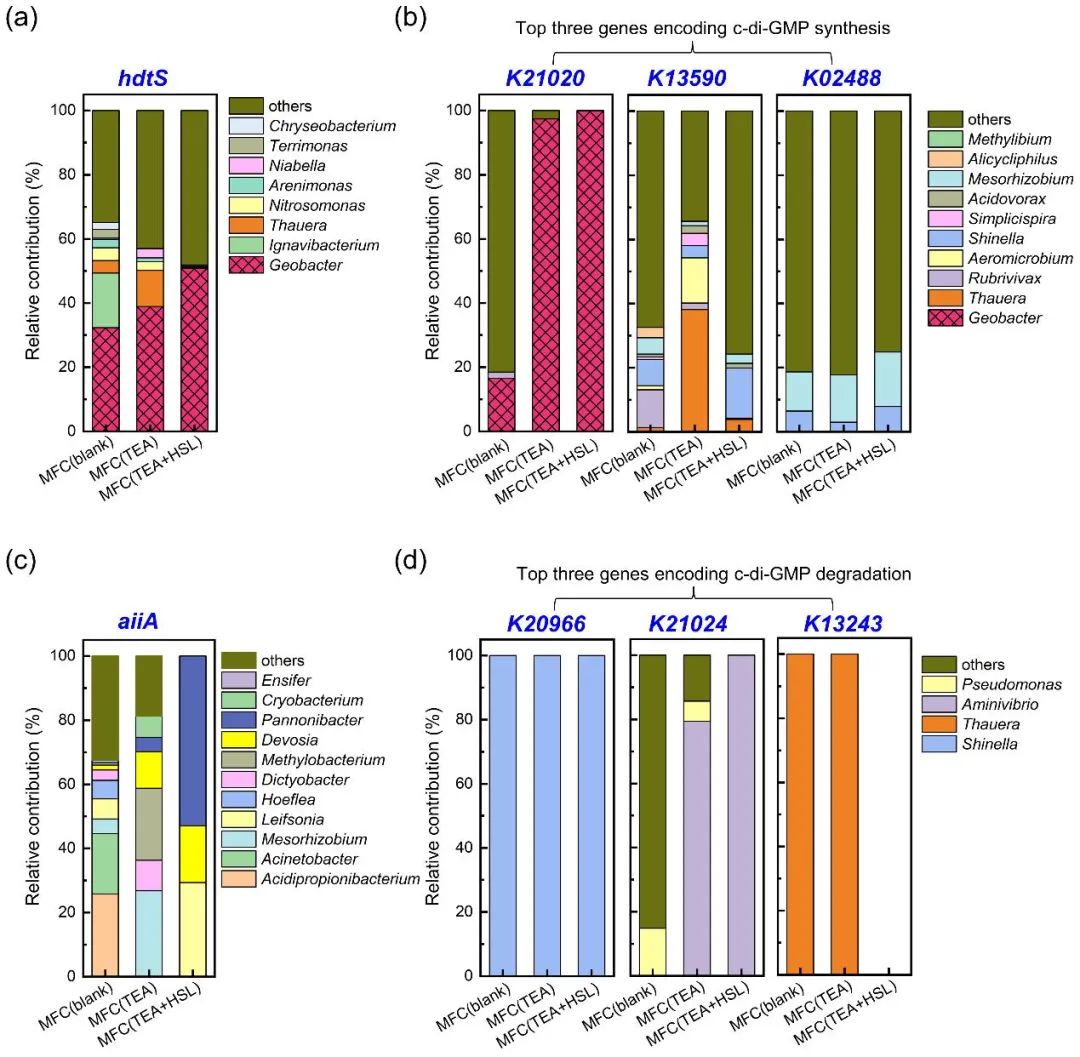
图6 优势菌与关键基因间的功能贡献度分析:(a)hdtS基因;(b)编码c-di-GMP合成的关键三个基因;(c)aiiA基因;(d)编码c-di-GMP降解的关键三个基因
利用信号通信调控电活性生物膜形成和微生物群落结构是一种新颖的策略。本文探索了在电信号通讯阻滞下,胞内c-di-GMP信号通讯和胞外AHLs介导的群体感应间的相互作用(图7)。可以预见,通过基因工程、酶调控等途径对细菌信号通讯途径进行精准调控将是调控电活性生物膜形成和微生物群落结构的重要方向。然而,为了进一步揭示电活性生物膜中潜在的信号通讯机制,仍需要开展一些研究。比如,有必要通过宏转录组学或代谢组学进一步研究混菌电活性生物膜中微生物的信号通讯机制。并且,对模式产电菌(如Geobacter sulfurreducens)的研究将为信号通讯机制提供更多具体信息。此外,还可以研究其它群体感应信号分子对电活性生物膜形成的影响,从而更全面地了解多种信号通讯方式间的相互作用。
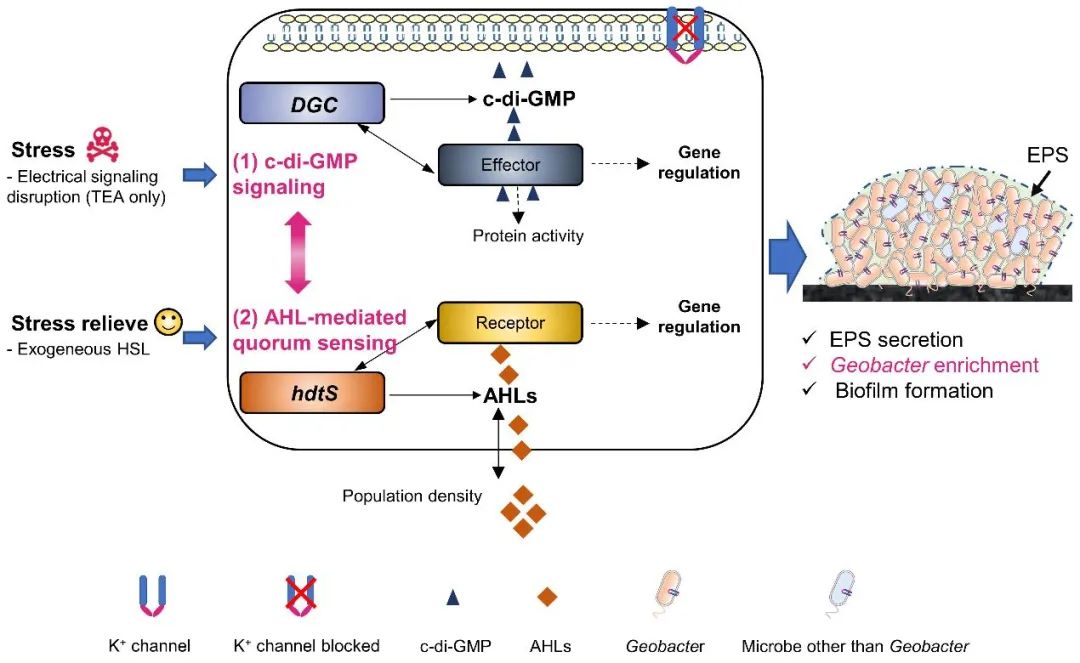
图7 电信号通讯阻滞下胞内c-di-GMP信号通讯与AHLs介导的群体感应对电活性生物膜形成的相互作用
作者简介

朱倩,现为湖北师范大学化学化工学院讲师。主要研究方向:微生物电化学系统、功能材料研发、光催化技术。目前以第一作者发表了一篇Water Research,三篇Bioresource Technology,一篇Science of the Total Environment和一篇Energy & Environmental Materials。

侯慧杰
,博士,华中科技大学教授,博士生导师,环境科学与工程学院副院长,国家级青年人才项目获得者。长期从事固废处理处置及资源化、微生物电化学技术、环境传感等方向研究,主持国家自然科学基金项目3项、湖北省杰出青年项目等,在 Adv Mater、Environ Sci Technol、Water Res 等权威期刊发表 SCI 收录论文 130 余篇,其中以第一通讯作者发表SCI论文50余篇,获批第一发明人专利11项。担任Environ Research,Frontiers in Microbiology等期刊编委。
通讯邮箱:houhuijie@hust.edu.cn

胡敬平
,博士,华中科技大学教授,博士生导师,国家级青年人才项目获得者。博士毕业于英国牛津大学化学系,博士毕业后先后在英国诺丁汉大学和牛津大学从事博士后研究,荣获Ramsay Fellowship。目前主要研究方向为环境催化、环境功能材料和固废资源化与污染控制技术。在Adv Mat、Adv Func Mat、Angew Chem等期刊发表论文190余篇,单篇最高他引210余次,总他引超过6000次,H因子44。担任Energy & Environmental Materials 期刊副主编、巴塞尔公约亚太区域中心化学品和废物环境管理智库专家、湖北省资源综合利用协会专家委员会委员,主持国家重点研发课题、国基金、省基金重点项目,承担科技部青年973项目。
通讯邮箱:hujp@hust.edu.cn
FunMat课题组微信公共号:

FunMat课题组主页:http://funmat.ese.hust.edu.cn/

